Guía Clínica
La palabra úlcera, procede del latín ulcera, que es el plural de ulcus, cuyo significado es llaga.
Se define como solución de continuidad con pérdida de sustancia de cualquier superficie epitelial del organismo, con escasa o nula tendencia a la cicatrización espontánea.
También se acepta la definición referente a procesos patológicos más específicos, como: Son pérdidas de sustancia de la piel o mucosas, como consecuencia de un proceso patológico, que en profundidad afectan por lo menos hasta el tejido conjuntivo sub-epitelial. Las úlceras debidas a traumatismos se denominan heridas.
Las úlceras pueden alcanzar la dermis superficial o profunda, la hipodermis o pueden llegar hasta la fascia, e incluso al hueso subyacente. Por su evolución, se pueden clasificar genéricamente en agudas y crónicas.
Es aquella solución de continuidad con pérdida de sustancia de cualquier superficie epitelial de organismo, con escasa o nula tendencia a la cicatrización espontánea y de larga duración ó con frecuencia recurrente.
Las heridas crónicas no siguen el patrón normal de reparación. La clave para que el tratamiento sea efectivo consiste en corregir la causa que originó la lesión y tratar el lecho de modo adecuado.
Actualmente se está en condiciones de intervenir en las diferentes etapas del proceso de cicatrización a través de la modificación del entorno de la herida. La reparación tisular consta de fases dinámicas que se pueden traslapar y que son:
- Hemostasia
- Inflamación
- Proliferación
- Remodelación
Todas estas acciones del proceso de regeneración tisular, tienen como objetivo el mantener un balance entre la producción de nuevo tejido y la degradación del mismo.
Las heridas crónicas son aquellas que se han detenido en la fase inflamatoria debido a un desbalance entre los factores de crecimiento y las proteasas. Este desequilibrio se debe a la presencia exagerada de citoquinas proinflamatorias, disminución de los factores de crecimiento, alteración en el depósito de colágeno y de la matriz, alteración de la proliferación celular y de la síntesis proteica y aumento de la apoptosis.
En las heridas crónicas los factores de crecimiento son captados por moléculas como la albúmina, el fibrinógeno y la α 2 - macroglobulina, que se extravasan hacia la dermis. La molécula de α 2 – macroglobulina es captadora del PDGF entre otros.
Las metaloproteinasas tienen una acción distinta a la que tienen en las heridas agudas. En las heridas crónicas el exudado contiene una excesiva cantidad de metaloproteinasas que comprometen a la matriz extracelular, y probablemente también contengan citoquinas y factores de crecimiento.
También hay que considerar que en los tejidos que rodean a las heridas crónicas, los fibroblastos son seniles e insensibles a ciertas citoquinas y factores de crecimiento, por ejemplo en las úlceras venosas no responden a la acción del TGF-β1 y del PDGF.
La causa por la cual una herida se transforma en crónica es multifactorial. Cuando la tensión de oxígeno se halla por debajo de los 40 mmHg, se enlentece la producción de colágeno, ya que este es el valor mínimo para la hidroxilación de prolina y lisina necesarias en la síntesis de colágeno maduro.
La perfusión inadecuada de los tejidos o hipoxia aumentan el riesgo de infección de la herida, ya que el oxígeno es esencial para que los leucocitos destruyan las bacterias y se estimule la síntesis de fibroblastos. Cuando se produce la contaminación de una herida, la carga bacteriana puede progresar hacia la colonización, luego a la colonización crítica y finalmente a la infección. Los neutrófilos pueden extender la lesión tisular por la liberación de proteasas y productos tóxicos de oxígeno, hay déficit de factores de crecimiento y degradación de la fibronectina, lo cual dificulta la migración de los fibroblastos.
La presencia de tejido necrótico en la herida retrasa la cicatrización ya que la migración de queratinocitos y fibroblastos está inhibida por la presencia citoquinas y mediadores de la inflamación, así como también está inducida la liberación de endotoxinas de la úlcera, creando un medio favorable para el desarrollo bacteriano.
En los diabéticos persiste la etapa inflamatoria con mayor cantidad de TNF y metaloproteinasas, alteración del IGF I y II, disminución de la proliferación de fibroblastos, con la consiguiente reducción del colágeno I y II y menor formación de matriz. Disminuye la disponibilidad de insulina para el anabolismo con mayor resistencia a la insulina en los receptores celulares. Disminuye el óxido nítrico y la función de los neutrófilos. Se altera la angiogénesis y la formación de tejido de granulación. La microangiopatía y la neuropatía, reducen la tensión de oxígeno con las consecuencias ya descriptas.
Las heridas se cronifican en los pacientes con corticoterapia prolongada porque los corticoides actúan en la fase inflamatoria inhibiendo a los macrófagos, la síntesis proteica y la proliferación celular. Los AINES actúan inhibiendo a las prostaglandinas, afectando la producción de colágeno. Los quimioterápicos alteran a los fibroblastos.
El frío puede reducir el flujo sanguíneo por vasoconstricción y producir hipoxia con disminución de la tensión de oxígeno subcutáneo, modificando la propiedad bactericida de los leucocitos, minimizando el depósito de colágeno y la fuerza tensil del tejido. El calor intenso puede favorecer la infección y combinado con el incremento de la presión en el tejido, aumenta la susceptibilidad del mismo a la injuria.
En los ancianos, la reepitelización es más lenta y al tener una disminución de la resistencia tensil, se incrementa el riesgo de dehiscencia.
Este consenso incluye un repaso del proceso de cicatrización normal y patológico, las distintas etiologías que pueden dar lugar a las heridas crónicas.
Se lleva a cabo mediante una sucesión organizada y compleja de procesos celulares y bioquímicos: inflamación, epitelización, granulación y fibroplasia / hemostasia, inflamación, proliferación y remodelación.
Al producirse una lesión, hay ruptura de vasos de sanguíneos, esta ruptura expone al colágeno subendotelial a las plaquetas, actuando la vía intrínseca de la cascada de la coagulación y en conjunto con la presencia de trombina, fibropectina y sus fragmentos, hacen que se liberen citocinas y factores de crecimiento desde los gránulos alfa plaquetarios en la forma de Factor de Crecimiento Derivado de Plaquetas (PDGF); Factor Transformante de Crecimiento B (TGF-B); Factor Activador Plaquetario (PAF), Fibronectina y Serotonina.
El coagulo de fibrina que se forma en el sitio de la lesión, es a manera de red o "entramado" que permite que penetren células tales como: neutrófilos, monocitos, fibroblastos y células endoteliales.
Los neutrófilos son las primeras células que llegan a la herida. Participación de los macrófagos en la cicatrización. Las principales funciones son Fagocitosis, Reclutamiento y actividad celular, angiogénesis, regulación de la síntesis de la matriz y desbridamiento de la herida. La migración celular es estimulada por el aumento de la permeabilidad vascular causada por la inflamación y por la liberación de prostaglandinas junto a un gradiente de concentración de sustancias quimotácticas tales como: Factores del Complemento, Interleucina 1, Factor de Necrosis Tumoral alfa (TNF-a), TGF-B, Factor Plaquetario-4 y productos bacterianos.
Los macrófagos al migrar y activarse en la herida, producen desbridamiento, síntesis de matriz y angiogénesis, liberando a su vez citocinas que favorecen la fibroplasia y que activan a los linfocitos para que estos liberen linfocinas tales como: Interferones (IFN) e Interleucinas(IL).
A manera de retroalimentación, el IFN- 8 actúa en macrófagos y monocitos induciéndolos a liberar otras citocinas como TNF-a e interleucina 1. Las células endoteliales forman nuevos capilares y los fibroblastos proliferan para favorecer el depósito de colágeno, que es la proteína predominante de la cicatriz.
Las finas fibras de colágeno neoformadas se unen mediante entrecruzamiento con las fibras de colágeno preexistente en el borde de la herida y poco a poco se remodelan, engruesan y organizan siguiendo las líneas de tensión de la herida, incrementando por ende la potencia tensil de la cicatriz. A la semana, la herida adquiere solo el 3% de su potencia, a las tres semanas 20% de sus resistencia final y a los tres meses adquiere 80% de resistencia. La degradación del colágeno durante la cicatrización comienza en fase temprana con gran actividad durante la inflamación.
Las fuentes de colagenasa son las células de la inflamación, endoteliales, fibroblastos y los queratinocitos.
La acumulación de la matriz durante la cicatrización ocurre por un equilibrio entre el depósito de material nuevo y su degradación.
La contracción de la herida representa la aproximación de sus bordes con el acortamiento de la cicatriz. La epitelización dará lugar al revestimiento del defecto.

Primera Intención: La cicatrización ocurre cuando el tejido lesionado es suturado con precisión y limpieza, la reparación ocurre con diminuto edema, sin infección local o abundante secreción y lo hace en un tiempo mínimo, sin separación de los bordes de la herida; condiciones deseadas por todos los cirujanos.
Segunda Intención: Es la cicatrización de una herida abierta o de un espacio inerte cerrado mediante la formación de tejido de granulación, y finalmente por cierre del defecto por la migración de células epiteliales.
La mayor parte de las heridas y quemaduras infectadas cicatrizan de esta forma.
Tercera Intención: Conocida también como cierre diferido o primario tardío.
Este es un método de reparación seguro para aquellas heridas contaminadas, sucias, infectadas y traumatizadas, que consiste en dejarlas abiertas inicialmente, para que al cabo de cuatro días en adelante, que se observe tejido de granulación limpio, sean cerradas mediante intervención quirúrgica.

Siempre que se rompe la integridad del tejido, el paciente es más vulnerable y la cicatrización puede tener complicaciones.
- Factores que entorpecen la cicatrización
- Malnutrición
- Vasoconstricción
- Hiperglucemia
- Uso de corticoesteroides.
Este es un método de reparación seguro para aquellas heridas contaminadas, sucias, infectadas y traumatizadas, que consiste en dejarlas abiertas inicialmente, para que al cabo de cuatro días en adelante, que se observe tejido de granulación limpio, sean cerradas mediante intervención quirúrgica.
Los requerimientos calóricos para la óptima cicatrización no han sido definidos hasta el momento. Los traumatismos extensos como las grandes quemaduras, aumentan el metabolismo, mientras que traumas de menor intensidad, como fracturas pequeñas, no aumentan los requerimientos nutricionales.
Para optimizar la reparación de la herida, los factores que representan isquemia de la herida deben ser prevenidos, por lo que el paciente debería mantenerse con calor suficiente y sin dolor para evitar vasoconstricción, evitar hipovolemia y suturas demasiado apretadas.
Sangre: La perfusión de los tejidos es lo que determina la nutrición y oxigenación de la herida. En pacientes normovolémicos, pero con anemia, en quienes su hematócrito es menor del 15% podría afectarse la síntesis de colágeno de la herida por el poco nivel de oxígeno contenido en la sangre, pero si incrementamos en estos pacientes la PO2 en sangre a niveles de cien por cien, la saturación de hemoglobina permitirá mayor difusión de oxígeno para la herida, la misma que aumenta su síntesis de colágeno.
Oxígeno: La herida requiere adecuada oxigenación para cicatrizar bien. Las heridas isquémicas cicatrizan deficitariamente y con alto riesgo de infección. Los factores comunes de isquemias de la herida son: enfermedad vascular obstructiva, vasoconstricción e hipovolemia, que en lo posible deben ser evitadas o corregidas.
Nutrición: El riesgo de dehiscencia aumenta en pacientes con hipoalbuminemia y por ende malnutridos. La cicatrización estará afectada en pacientes con pérdida de peso reciente de 15-25% de su peso corporal inicial con disminución de proteínas.
En el trauma aumentan los requerimientos calóricos, razón por la cual debería cubrirse las demandas para favorecer la cicatrización. El ácido retinoico ó vitamina A, debería ser administrada como suplemento por sus elevados requerimientos en el trauma, y además en pacientes en tratamiento crónico de corticoterapia, para revertir sus efectos colaterales y permitir la cicatrización.
La deficiencia de piridoxina o vitamina B6 afecta la formación de red de colágeno: Las deficiencias de tiamina o vitamina B1 y riboflavina o vitamina B2 causan síndromes asociados con la reparación inadecuada de la herida.
Los déficits de elementos como zinc y cobre intervienen en la incorrecta cicatrización por ser cationes divalentes y cofactores de importantes reacciones enzimáticas: La deficiencia de zinc está asociada con epitelización defectuosa y heridas crónicas.
Ácido Ascórbico: La vitamina C o ácido ascórbico es necesaria para la hidroxilación de los residuos de prolina y lisina. Sin la hidroxiprolina sintetizada, el colágeno no es transportado fuera de la célula y sin la síntesis de hidroxilisina, los factores de colágeno no se entrecruzan.
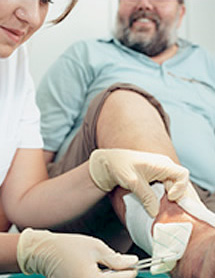
Es necesario conocer los conceptos asociados con la preparación del lecho de la herida, ofreciendo grandes posibilidades para mejorar la calidad de vida de los pacientes cuyas heridas cicatrizan con dificultad, debido a que cada una presenta características y dificultades singulares, diferentes.
La preparación del lecho de la herida es un evento DINÁMICO que debe adaptarse a las necesidades de la herida y al proceso de cicatrización.
Actualmente existen pautas a seguir para ayudar a los médicos a desarrollar un enfoque global para eliminar los obstáculos y estimular el proceso de cicatrización con el fin de optimizar el manejo de las heridas crónicas.
Es un esquema dinámico que consta de cuatro etapas:
- Control del tejido no viable: Se trata de una herida abierta, crónica y de lenta cicatrización, cubierta de tejido necrótico, que precisa desbridamiento
- Control de la inflamación y de la infección: Esta herida ha sido colonizada o infectada críticamente y la recuperación es lenta. Se necesitan agentes antimicrobianos y más desbridamiento
- Control del exudado: Debido a la infección o la inflamación, la herida produce más exudado y ahora el enfoque se centra en el equilibrio de éste
- Estimulación de los bordes epiteliales: Cuando se resuelve la colonización o infección crítica y se equilibra la humedad, el enfoque debe centrarse en el avance de los bordes epiteliales.

